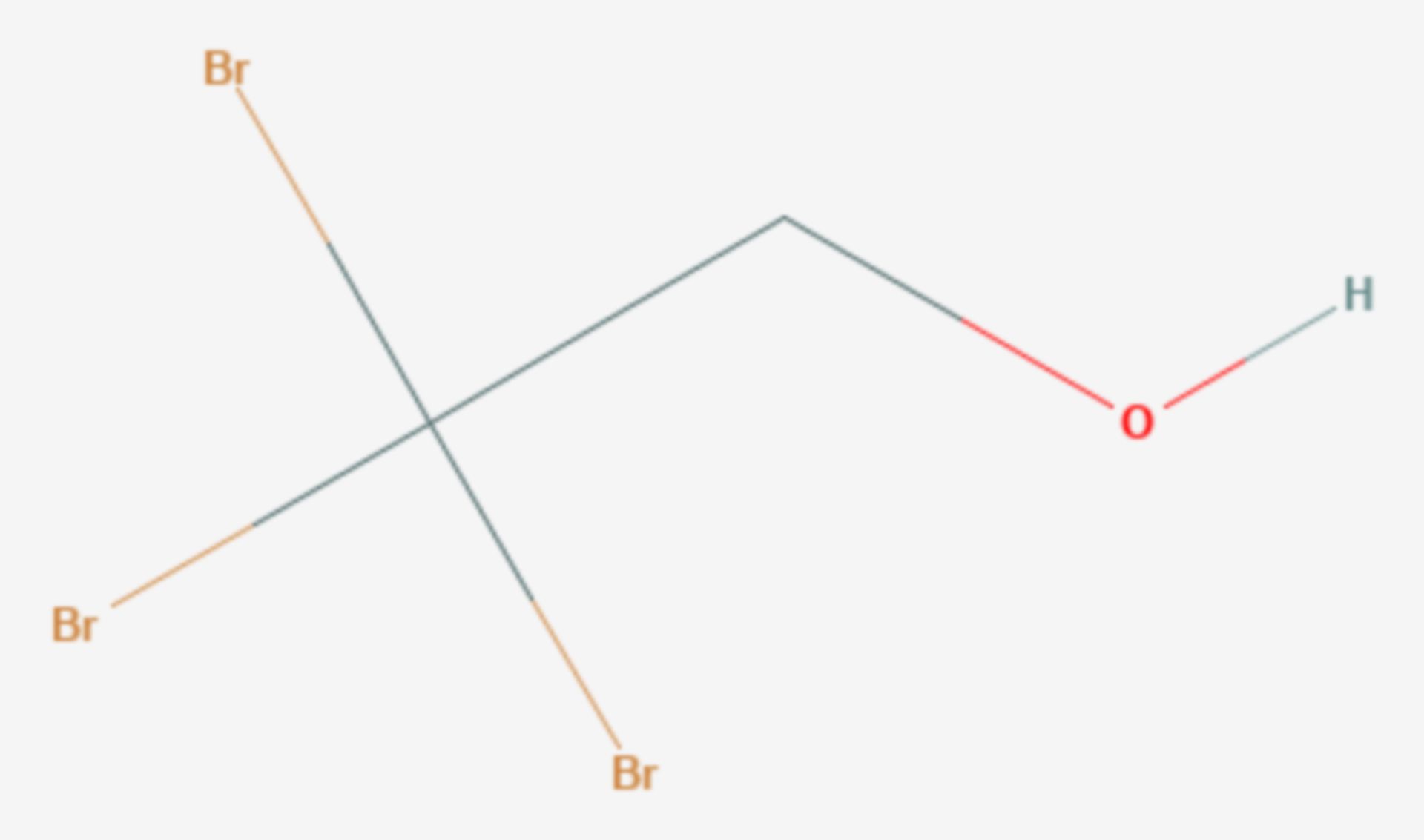
Stickstofftribromid ist eine chemische Verbindung, die zur Gruppe der Stickstoffhalogenide gehört. Durch ihre Empfindlichkeit und hohe Explosivität gibt es keine praktische Anwendung für die Verbindung.
Vorkommen
Wird bei der Desinfektion von Schwimmbäder anstelle von Chlor Brom eingesetzt, kann durch die Reaktion mit Harnstoff aus menschlichen Ausscheidungen als Nebenprodukt Stickstofftribromid entstehen.
Gewinnung und Darstellung
Stickstofftribromid lässt sich gewinnen durch Bromierung von Stickstofftrichlorid
oder durch Umsetzung von Ammoniumbromid, Natriumchlorit und Eisen(III)-bromid
oder durch Reaktion von Bis(trimethylsilyl)bromamin mit Bromchlorid bei −85 °C in Pentan als Lösungsmittel
Auch durch Elektrolyse einer Ammoniumiodid- und Kaliumbromidlösung (NH4I KBr) kann Stickstofftribromid hergestellt werden.
Bei der Explosion zerfällt Stickstofftribromid in die Elemente:
Literatur
- Jochen Jander: Non-Aqueous Solvents for Preparation and Reactions of Nitrogen Halogen Compounds (PDF; 477 kB). Pure & Appl. Chem., Vol. 49, S. 67–73.
Einzelnachweise